Биолозите на ракот допрва треба да ги разберат механизмите и клеточната хиерархија што водат до развојно застој кај рабдомиосаркомот (RMS) – група педијатриски карциноми, кои остануваат енигматски. Во новиот извештај во Science Advances, Сара Г. Даниели и меѓународен, интердисциплинарен тим на научници од одделот за онкологија и детско истражување, биологија на матични клетки и преведувачки истражувања за рак на деца и адолесценти, во САД, Швајцарија, Франција, Германија и Шпанија, комбинираа огромен број биолошки методи за да ја разберат етиологијата и клеточната основа на RMS онкогенезата.
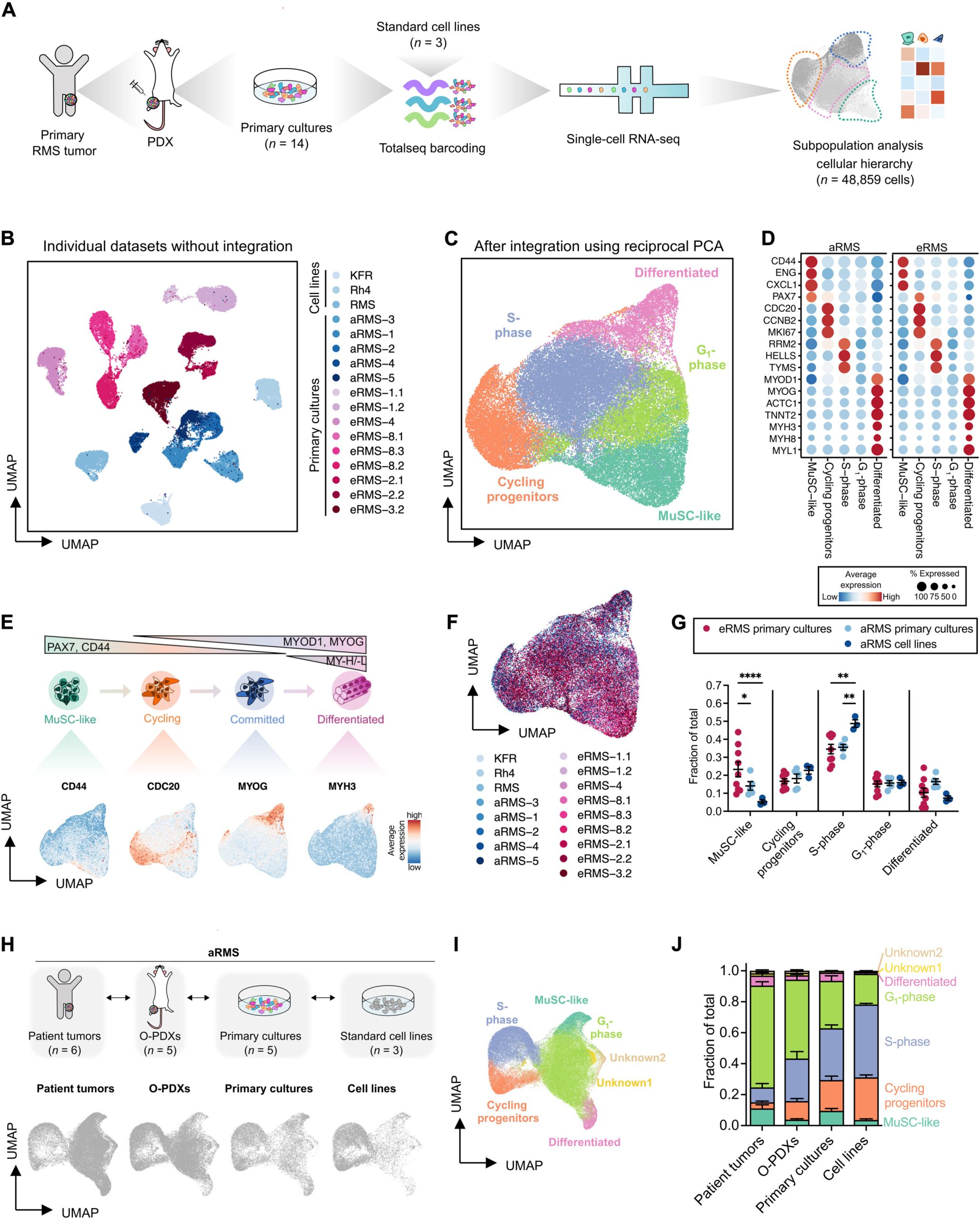
Тимот инкорпорираше секвенционирање на едноклеточна РНК, масовна цитометрија и методи на сликање со висока содржина за да ја разбере интратуморалната разновидност на биопсиите добиени од пациентите. Агресивниот алвеоларен подтип (aRMS) содржеше пластични мускулни матични клетки и прекурсори на раст на туморот заедно со субпопулација на диференцирани клетки без пролиферативен потенцијал што доведе до подобри резултати.
Научниците спроведоа хемотерапија и ја набљудуваа динамиката на агресивната алвеоларна верзија на болеста. Тие потоа ги прегледаа кандидатите за лекови и нивниот капацитет да ја пропагираат болеста кон клинички поволни под-популации и идентификуваа комбинација од брзо забрзан фибросарком (RAF) и инхибитори на митоген активиран протеин киназа (МЕК) за да предизвикаат мускулна диференцијација и да го инхибираат растот на туморот. Овие резултати обезбедуваат увид за развој на биолошки состојби во основата на болеста, вклучувајќи агресивност, хемоотпорност и клеточен раст, истовремено идентификувајќи ја патеката Рас како ветувачка терапевтска цел.
Ракот во детството води до нерегулиран човечки развој и е водечка причина за морбидитет и морталитет поврзан со болести кај децата и адолесцентите. Неодамнешниот напредок во едноклеточните технологии може да помогне во карактеризацијата на интратуморалната разновидност и да фрли светлина на фенотипската пластичност кај неколку типови на рак за да се нагласи нивната улога како појавни белези на онкогенезата.
Истражувачите ги проучуваат развојните хиерархии на детските болести за да го идентификуваат нивното потекло и да развијат ефективни стратегии за третман кои ги таргетираат клеточните компоненти. Рабдомиосаркомот е чест педијатриски сарком на меките ткива што се јавува како ембрионски и алвеоларни (aRMS) подтипови, од кои вториот е поагресивен поради неговата основна генетска основа.
Во тековната студија, Даниели и колегите комбинираа секвенционирање на scRNA, масовна цитометрија и анализа на слики со висока содржина за да ја испитаат интратуморната хетерогеност на клеточните линии на ракот и примарните култури добиени од ксенографти добиени од пациенти.
Тимот потоа ги скринираше регулаторите на судбината на клетката на алвеоларниот рабдомиосарком (aRMS) преку библиотека на фармацевтски соединенија, вклучувајќи ги и инхибиторите на патеката RAS траметиниб со дабрафениб или регорафениб за да ги насочат овие канцерогени клетки да се разликуваат. Комбинаторните терапии потенцијално го потиснаа растот на туморот кај ксенографтите добиени од пациентите за да обезбедат силна причина за клиничка манипулација на RAS патеката за да се спротивстави на онкогенезата кај пациентите.
Истражувачите користеле секвенционирање на едноклеточна РНК засновано на капки за да ја разберат интратуморалната разновидност на канцерогените клетки со профилирање на 14 ксенографти добиени од пациенти и три конвенционални клеточни линии на алвеоларен рабдомиосарком во споредба со претходните студии. Тимот ја зголеми меѓупациентната варијабилност со избирање модели на болеста кои потекнуваат од различни онкогени подтипови, вклучувајќи примарни и метастатски места меѓу дијагностички и рекурентни пациенти кои имале или не биле подложени на предтретман.
Резултатите открија како туморите на RMS содржат миогени клетки заглавени во незрела транскрипциона состојба за на крајот да формираат малцинство од диференцирани клетки. Научниците го потврдија присуството на подпопулациите на ниво на протеини со боење на примарните клеточни култури со панел на антитела конјугиран со изотоп за да се изолираат клетките слични на мускулните матични, кои ги идентификуваа користејќи секвенционирање на едноклеточна РНК за да ги дефинираат различните состојби на миогенезата.
Потоа, тие ги профилираа клетките со користење на цитометрија преку анализи за време на летот, каде што резултатите од истражувањето покажаа дека подмножеството на aRMS-клетки е од специфичен интерес. Резултатите од анализата на едноклеточниот протеин се усогласени со транскриптомската анализа.
Тимот го демонстрираше механизмот на дејство на фенотиповите на ракот RMS што ги отсликуваше одлуките за судбината на клетките за развој, здрави и регенерирани матични клетки на скелетните мускули. Тие ја проучувале оваа врска преку модел за заклучување на траекторијата заснован на алатките за визуелизација на податоци Slingshot и PHATE, за да ја замислат структурата и транзициите во високодимензионалните биолошки податоци. Кога научниците го проектираа едноклеточниот атлас за секвенционирање на РНК на човечките скелетни мускули во развој на онкогениот едноклеточен транскриптом; клетките на туморот најмногу се мапирале на мускулните клетки кои транзитирале од ембрионската во феталната фаза.
Научниците забележаа дека главниот двигател на подтипот aRMS е генот за спојување PAX3::FOX01; познато дека ја потиснува миогената диференцијација. За да ги проучи гените, тимот користел две клеточни линии aRMS со нокдаун против гените за фузија; овие мерки за третман резултираа со намалени нивоа на генот за фузија за да се нагласи капацитетот на генот за соборување на клеточните линии или да подлежат на диференцијација или да застанат во состојба слична на мускулното стебло, овозможувајќи продолжување на насочената фузија-генска терапија. Исто така, се чинеше дека некои клеточни линии кои суштински се спротивставуваат на третманот биле подложени на повторно поврзување на клеточната траекторија.
Истражувачите го набљудуваа механизмот на дејство на Траметиниб, кој ја киднапираше клеточната судбина на клеточната линија aRMS отпорна на третман и ги пренасочи овие клетки кон диференцијација. Од скринираните делови на лекови Траметиниб, Кобиметиниб и Ердафитиниб индуцираа силна миогена диференцијација.
Бидејќи монотерапијата останува да успее во клиничките испитувања, тимот го идентификуваше поефективниот комбинаторен скрининг на лекови за да ја демонстрира супресијата на RAS патеката предизвикана од траметиниб во комбинација со инхибиција на РАФ како изводлива стратегија за третман за ARMS.
На овој начин, Сара Г. Даниели и неговите колеги развија сеопфатен едноклеточен транскриптомски и протеомски атлас на рабдомиосарком (RMS). Атласот ја детализираше клеточната и функционалната разновидност на болеста и ги откри клучните клеточни и молекуларни потписи погодни за терапевтска интервенција за надминување на хеморезистенција и релапс на туморот. Истражувачите го опишаа механизмот на дејство на судбината на клетките што лежи во основата на нарушената диференцијација во подтипот на рак на агресивен алвеоларен рабдомиосарком (aRMS). Работата фрла светлина на тоа како терапевтски да се врати миогената диференцијација и да се блокира растот на туморот.
Повеќе информации:
Сара Г. Даниелли и сор., Едноклеточното профилирање на алвеоларниот рабдомиосарком ги открива инхибиторите на патеката на РАС како киднапери на клеточната судбина со терапевтска важност, Science Advances (2023). DOI: 10.1126/sciadv.ade9238
Simone Hettmer et al, Muscling во: Откривање на потеклото на рабдомиосарком, Nature Medicine (2010). DOI: 10,1038/nm0210-171
© 2023 Science X Network.